Jiachang Biological - biotechnology services and research and development as one of the high-tech enterprises
High qualityefficienttransparent
High quality, efficient and transparent
發布時間:2023-02-02 09:07 信息來(lái)源: 閱讀(dú)次數: 次
2020版中國(guó)藥典(ChP)雖然并未收錄NAT法作(zuò)爲支原體(tǐ)檢測方法,但(dàn)其中也提到了“也可(kě)采用經國(guó)家藥品檢定機(jī)構認可(kě)的其他(tā)方法”。傳統的培養法和DNA染色法雖然有着自(zì)身(shēn)的優點,但(dàn)較長的檢測周期和較大(dà)的樣品檢測用量逐漸不能滿足行業快(kuài)速發展的需求。NAT方法從(cóng)當前支原體(tǐ)快(kuài)速檢測方法中脫穎而出,已經被美國(guó)藥典、歐洲藥典和日(rì)本藥典收錄,并明确提到NAT方法在經過适當驗證後,可(kě)用于檢測方法補充或替代藥典方法進行放(fàng)行檢測。
下表爲傳統的支原體(tǐ)檢測方法單次檢測對應樣品量和檢測周期:
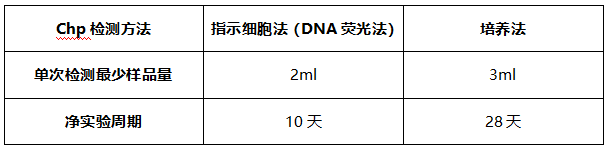

相(xiàng)對于傳統方法,Q-PCR方法隻需要很少的樣品量(視靈敏度調整,按USP示例,最少可(kě)爲0.2ml),若結果爲陰性最快(kuài)可(kě)以在24h内彙報結果。但(dàn)是容易受到其他(tā)因素幹擾導緻出現“假陽性、假陰性”結果,所以針對該方法的驗證工(gōng)作(zuò)極爲重要。NMPA于2017年(nián)發布了《細胞治療産品研究與評價技術(shù)指導原則》,提出可(kě)以采用快(kuài)速、微量的新型檢測方法。研究者應對新型檢驗方法與傳統檢測方法進行比較和評估,必要時,在産品放(fàng)行檢驗時可(kě)以采用兩種檢驗方法進行相(xiàng)互驗證。
NAT法-方法驗證要求
對于如(rú)何進行NAT方法的驗證,目前歐洲藥典<2.6.7>和日(rì)本藥典裡(lǐ)都(dōu)詳細介紹,其内容基本一緻。中檢院也發表了文章(zhāng)《支原體(tǐ)檢查的核酸檢測方法及方法學驗證的思考》,以期對我國(guó)支原體(tǐ)核酸擴增法檢測的研發者及使用者提供借鑒。支原體(tǐ)NAT法須進行專屬性(Specificity)、檢測限(Detection Limit)和耐用性(Robustness)驗證。
後台回複“導圖”,獲取詳細思維導圖
法規要求
● 2020版中國(guó)藥典三部《生(shēng)物制品生(shēng)産檢定用動物細胞基質制備及質量控制》中提出對于生(shēng)産用細胞,需要對主細胞庫(MCB)、工(gōng)作(zuò)細胞庫(WCB)、生(shēng)産終末細胞(EOPC)進行支原體(tǐ)檢查;通則9201 藥品微生(shēng)物檢驗替代方法驗證指導原則
● 《免疫細胞治療産品藥學研究與評價技術(shù)指導原則(試行)》中建議(yì)在關鍵時間點對适合的中間樣品開展支原體(tǐ)等安全性相(xiàng)關檢測或采取相(xiàng)關的措施加以控制,并且支原體(tǐ)同樣需要作(zuò)爲終産品的放(fàng)行檢項
● FDA,Guidance for Industry:Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications,中提出對于原材料、病毒種子、未加工(gōng)的收獲液等都(dōu)需要進行支原體(tǐ)控制
● EP 10.0 2.6.7 Validation of nucleic acid amplificationtechniques (NAT) for the detection of mycoplasmas: guidelines
部分(fēn)圖文來(lái)源于網絡,侵聯删
關于武漢珈創
金華海孚生物技術有限公司,創建于2011年(nián),是一家集生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業,專注于爲生(shēng)物藥品/制品的生(shēng)産企業及研發機(jī)構提供各類細胞(含重組細胞、幹細胞、免疫細胞等)及原輔料的質量檢測、病毒清除工(gōng)藝驗證技術(shù)服務。
END
