珈創生(shēng)物 —— 生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業
優質高效透明
High quality, efficient and transparent
發布時間:2022-09-15 17:15 信息來(lái)源: 閱讀(dú)次數: 次
武漢珈創生(shēng)物祝賀合作(zuò)夥伴安徽中盛溯源、康希諾、百奧泰近日(rì)喜獲審批,祝願他(tā)們再創新高!
接下來(lái),珈創小助手将帶你(nǐ)回顧近期行業申報熱(rè)點資訊,了解行業動态。
近期行業重磅申報審批盤點
▼
01
2022年(nián)9月8日(rì),據CDE官網顯示,安徽中盛溯源生(shēng)物科(kē)技有限公司(下面簡稱“中盛溯源”)的“NCR100注射液”獲批臨床,拟開展針對膝骨關節炎的臨床試驗。根據中盛溯源官網,該藥物應該爲一款iPSC來(lái)源的細胞治療藥物。

幹細胞療法作(zuò)爲一種突破性的治療方法,可(kě)以在一定的條件(jiàn)下将幹細胞誘導分(fēn)化成軟骨細胞或者成骨細胞,經過增殖生(shēng)成大(dà)量的高質量的軟骨細胞後注入到人(rén)體(tǐ)當中。進而對那些出現損傷的軟骨器官進行修複,達到治愈膝骨關節炎的效果。
02
近日(rì),康希諾生(shēng)物股份公司吸入用重組新型冠狀病毒疫苗(5型腺病毒載體(tǐ))克威莎®(Convidecia)霧優®,已通過國(guó)家藥品監督管理(lǐ)局組織論證同意作(zuò)爲加強針納入緊急使用。
克威莎®霧優®在肌注型腺病毒載體(tǐ)新冠疫苗克威莎®的基礎上創新給藥方式,用霧化器将疫苗霧化成微小顆粒,通過口腔吸入的方式完成接種。該接種過程無需針刺,一呼一吸間即可(kě)獲得(de)高效免疫保護
03
百奧泰生(shēng)物制藥股份有限公司(證券代碼:688177)最近收到國(guó)家藥品監督管理(lǐ)局核準簽發的關于公司在研産品注射用 BAT8008 的《臨床試驗批準通知書(shū)》。
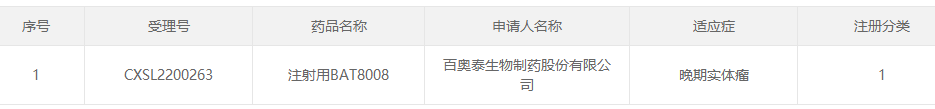
BAT8008 是百奧泰開發的靶向 Trop2 的抗體(tǐ)藥物偶聯物(ADC),拟開發用于實體(tǐ)腫瘤治療。Trop-2(Trophoblast cell-surface antigens 2,Trop2),又稱爲TACSTD2、M1S1、GA733-1、EGP-1),是腫瘤相(xiàng)關鈣信号轉導蛋白(bái)(Tumor associated calcium signal transducer,TACSTD)基因家族的一員(yuán),與細胞内鈣離(lí)子濃度的調控有關。
Trop2在正常人(rén)體(tǐ)組織中不表達或低表達,高表達于多種類型的人(rén)類腫瘤組織,該差異使得(de) Trop2 成爲 ADC 藥物的熱(rè)門(mén)靶點。BAT8008 由重組人(rén)源化抗 Trop2 抗體(tǐ)與毒性小分(fēn)子拓撲異構酶 I 抑制劑通過自(zì)主研發的可(kě)剪切連接子連接而成。BAT8008 具有高效的抗腫瘤活性,毒素小分(fēn)子有較強的旁觀者效應,可(kě)有效克服腫瘤組織的異質性。同時,BAT8008 具有較好的穩定性及安全性,血漿中釋放(fàng)的毒素小分(fēn)子極低,降低了脫靶毒性的風(fēng)險。
04
近日(rì),細胞療法公司Immusoft宣布,FDA已批準其工(gōng)程化B細胞療法ISP-001用于治療MPSI(I型粘多糖貯積症)的IND申請(qǐng)。ISP-001是一種基于Immusoft的免疫系統編程(ISP™),能避免與病毒傳遞相(xiàng)關的免疫原性和化療預處理(lǐ)并且可(kě)持續進行治療性蛋白(bái)質遞送的工(gōng)程化B細胞療法,該藥物已獲得(de)FDA孤兒藥物指定并将于今年(nián)啓動1期研究。如(rú)果進展順利,ISP-001将成爲首個進入臨床試驗的工(gōng)程化B細胞療法。
該療法可(kě)對患者的B細胞進行重新編程,以持續生(shēng)産治療性蛋白(bái)質,從(cóng)而減少頻繁輸注的需要,并改善患者的預後
05
近期,國(guó)家藥監局藥品審評中心(CDE)官網顯示,北京康愛瑞浩生(shēng)物科(kē)技股份有限公司(以下簡稱:康愛生(shēng)物)自(zì)主研發的KACM001自(zì)體(tǐ)淋巴細胞注射液産品正式獲得(de)臨床試驗默示許可(kě),拟聯合替吉奧/奧沙利鉑或順鉑治療局部晚期不可(kě)切除或轉移性胃癌。是目前國(guó)内首個聯合一線治療方案,針對實體(tǐ)腫瘤的1類新藥。同時,KACM001在其他(tā)實體(tǐ)腫瘤治療中同樣展現了明顯的安全和有效性,未來(lái)有望成爲新一代廣譜抗腫瘤藥物。
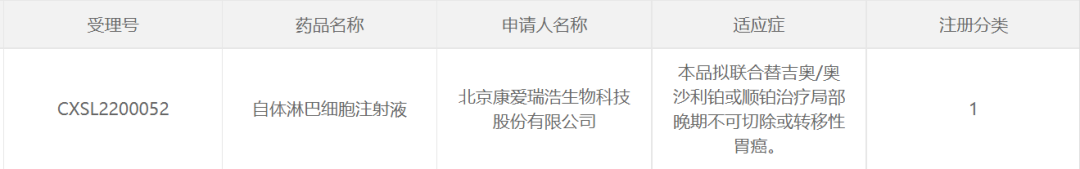
MTCA-CTL免疫療法是國(guó)内推出的新一代生(shēng)物免疫治療模式。在保證非MHC(主要組織相(xiàng)容性複合體(tǐ))限制性殺傷性NK-T細胞擴增的同時,定向擴增HC限制性的CD8+特異性CTL細胞(細胞毒性T淋巴細胞),使其在細胞産品中的比率可(kě)達到60%~70%。這種殺傷細胞的共同作(zuò)用,使殺傷腫瘤細胞的效率更高。
06
8月17日(rì),藍鳥生(shēng)物宣布美國(guó)FDA批準Zynteglo用于治療β地中海貧血。這是第一個針對需要定期輸血的 β地中海貧血患者的基因療法。據了解,藍鳥生(shēng)物爲Zynteglo的定價爲280萬美元,超過諾華的基因療法Zolgensma(定價210萬美元),一躍成爲“史上最貴藥”。
該療法是一種定制設計(jì)的一種一次性基因療法,它通過将β-珠蛋白(bái)基因的修飾形式的功能拷貝添加到患者自(zì)身(shēn)的造血幹細胞中來(lái)發揮作(zuò)用。
07
8月11日(rì),阿斯利康(AstraZeneca)和第一三共制藥( Daiichi Sankyo)共同研發的乳腺癌藥物 Enhertu(德喜曲妥珠單抗,簡稱T-DXd,DS-8201)獲批新适應症,成爲首款治療非小細胞肺癌的HER2靶向藥。
紀念斯隆-凱特琳癌症中心的Bob T. Li博士表示:“這是肺癌治療的一個重要裡(lǐ)程碑。經過二十年(nián)的研究之後,首個 HER2 靶向治療方案的批準證實了 HER2 基因是肺癌靶向治療的重要靶點,并标志着在治療NSCLC方面向前邁出了重要一步。”
08
8月31日(rì),美國(guó)食品藥品監督管理(lǐ)局(FDA)批準Moderna、輝瑞/BioNTech針對奧密克戎變異株 BA.4/BA.5的二價新冠mRNA疫苗的緊急使用授權(EUAs)申請(qǐng),授權兩家公司的二價mRNA疫苗作(zuò)爲單劑加強針,在完成接種基礎劑量疫苗,或者在最新一劑加強針至少兩個月後,方可(kě)接種。該款從(cóng)研發到獲批,僅用了60餘天。

09
近日(rì)(2022年(nián)9月2日(rì)),勃林格殷格翰宣布,FDA批準IL-36R單抗spesolimab上市,用于治療泛發性膿疱型銀屑病(GPP)發作(zuò),商品名爲Spevigo。Spesolimab治療GPP适應上市申請(qǐng)已獲EMA受理(lǐ),并于今年(nián)3月被CDE納入優先審評。
spesolimab是一款first-in-class靶向IL-36單抗,可(kě)阻斷白(bái)細胞介素-36受體(tǐ)(IL-36R)作(zuò)用。
10
近日(rì),CDE官網公示顯示,華夏英泰(北京)生(shēng)物技術(shù)有限公司(簡稱“華夏英泰”)提交的HXYT-001細胞注射液獲得(de)一項臨床試驗默示許可(kě),拟開發用于治療複發/難治 B 細胞非霍奇金淋巴瘤(B-NHL), 包括彌漫大(dà) B 細胞淋巴瘤、原發縱膈大(dà) B 細胞淋巴瘤、濾泡性淋巴瘤轉化的彌漫大(dà) B 細胞淋巴瘤、 濾泡性淋巴瘤 3b 級、高級别 B 細胞淋巴瘤伴 MYC 和 BCL2 和/或 BCL6 重排和高級别 B 細胞淋巴瘤-非特指型。

11
近日(rì),CDE官網公示顯示,深圳市華藥康明生(shēng)物藥業有限責任公司(簡稱“華藥康明”)提交的KM1溶瘤痘苗病毒注射液獲得(de)一項臨床試驗默示許可(kě),拟開發用于晚期無有效治療手段的惡性實體(tǐ)瘤。

圖片及内容來(lái)源于網絡,本平台旨在共享知識,如(rú)侵聯删。
關于珈創生(shēng)物
金華海孚生物技術有限公司,創建于2011年(nián),是一家集生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業,專注于爲生(shēng)物藥品/制品的生(shēng)産企業及研發機(jī)構提供各類細胞(含重組細胞、幹細胞、免疫細胞等)及原輔料的質量檢測、病毒清除工(gōng)藝驗證技術(shù)服務。