珈創生(shēng)物 —— 生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業
優質高效透明
High quality, efficient and transparent
發布時間:2020-01-16 09:59 信息來(lái)源: 閱讀(dú)次數: 次
前言
近年(nián)來(lái),DNA 重組技術(shù)在醫藥領域的飛速發展,使得(de)采用哺乳動物細胞表達系統的生(shēng)物制品藥物逐漸成爲主流,而對于此技術(shù)的主要原材料---細胞系和其他(tā)原料的檢定要求也日(rì)趨嚴格。

随着質量源于設計(jì)(QbD)理(lǐ)念越來(lái)越廣泛的得(de)到認可(kě),意味着僅僅依靠檢測終産品來(lái)保證藥品質量是遠(yuǎn)遠(yuǎn)不夠的,這個理(lǐ)念和生(shēng)物制品一直堅持的全過程質量控制的基本方針是基本一緻的。基于這一理(lǐ)念,把控生(shēng)産用細胞的構建、鑒定,以及細胞庫的建立和管理(lǐ),能夠從(cóng)源頭上保證産品質量的穩定。
2015年(nián)版《中國(guó)藥典》三部“生(shēng)物制品生(shēng)産用動物細胞制備及檢定規程”中,對于生(shēng)産用細胞基質的質量控制提出了要求。對于生(shēng)産用細胞,需要建立細胞庫,細胞庫的建立可(kě)爲生(shēng)物制品的生(shēng)産提供檢定合格,質量相(xiàng)同,能持續穩定傳代的細胞。在細胞庫建立之後,應至少對MCB和生(shēng)産終末細胞進行一次全面檢定。當生(shēng)産工(gōng)藝發生(shēng)改變時,還(hái)應重新對生(shēng)産終末細胞進行全檢。細胞檢定主要包括以下幾個方面:細胞鑒别、外源因子和内源因子的檢查、成瘤性/緻瘤性檢查等。細胞檢定的基本要求見(jiàn)下表:
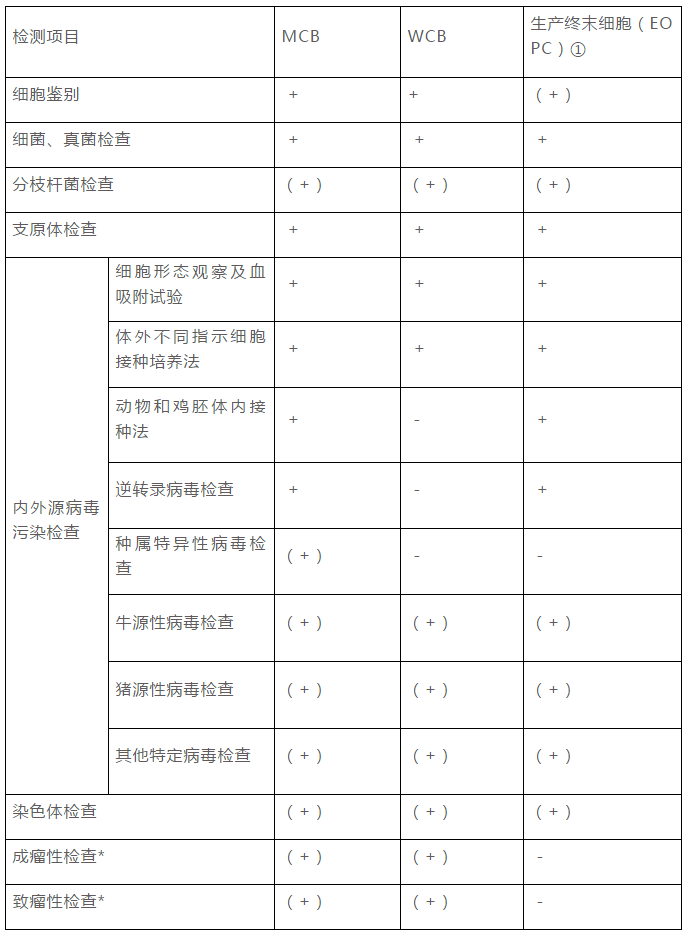

細胞庫的檢定,對于保證細胞庫的質量和爲後續工(gōng)藝提供穩定的合格的細胞尤爲必要,此部分(fēn)的工(gōng)作(zuò)對生(shēng)物制品産品而言非常重要。在進行項目選擇時,可(kě)參考《中國(guó)藥典》三部“生(shēng)物制品生(shēng)産用動物細胞制備及檢定規程”。
大(dà)多數生(shēng)物制品産品是有活性的,無法采用傳統的終端滅菌工(gōng)藝,因此在細胞庫建立和生(shēng)産的各個階段都(dōu)需要對無菌性進行檢定,其中分(fēn)枝杆菌的檢查是2015年(nián)版藥典新增項目,檢定時應關注。
支原體(tǐ)的污染則是基礎研究和工(gōng)業生(shēng)産中的常見(jiàn)問(wèn)題,據報道可(kě)能有高達87%的細胞系發生(shēng)過支原體(tǐ)污染,支原體(tǐ)在光(guāng)學顯微鏡下不可(kě)見(jiàn),一般不引起培養物渾濁,因此支原體(tǐ)污染一般很難察覺,支原體(tǐ)檢測也十分(fēn)必要。
感染性病毒顆粒污染生(shēng)物制品和生(shēng)物制品衍生(shēng)産品是被廣泛關注的安全問(wèn)題,對于細胞表達系統可(kě)能帶來(lái)的病毒污染問(wèn)題世界各國(guó)均十分(fēn)重視,ICH Q5A中規定了相(xiàng)應的技術(shù)要求(ICH關于“生(shēng)物技術(shù)産品的病毒安全性評價”)。綜合以上因素對于病毒因子的檢查應該盡量充分(fēn)全面。内外源病毒的檢定應充分(fēn)考慮細胞的特性,傳代曆史,培養過程等因素。例如(rú):
作(zuò)爲單克隆抗體(tǐ)等生(shēng)物制劑最常用的生(shēng)産用細胞系,中國(guó)倉鼠卵巢細胞(CHO)和小鼠NS0和Sp2/0等細胞系,由于其細胞來(lái)源的供體(tǐ)或細胞取材的原因,需要關注其特定種屬(鼠源)病毒的檢查。
對于細胞建庫過程中使用過動物來(lái)源的原料:如(rú)牛血清,或胰蛋白(bái)酶(豬),還(hái)需對特定的動物來(lái)源的病毒進行檢定。

另外,2015版《中國(guó)藥典》三部的主要變化還(hái)有,新增了“人(rén)用重組DNA蛋白(bái)制品總論”和“單克隆抗體(tǐ)類生(shēng)物治療藥物總論”這兩個總論的制定爲生(shēng)物制品藥物的研發和質量控制提供了通用的指導原則。其中“人(rén)用重組DNA蛋白(bái)制品總論”對于連續培養的生(shēng)産方式,要求應對收獲階段的微生(shēng)物污染進行常規檢測;“單克隆抗體(tǐ)類生(shēng)物治療藥物總論”則提出:細胞培養和收獲可(kě)采用限定細胞傳代,單次收獲産物的方式;也可(kě)采用限定細胞傳代時間,連續傳代多次收獲的方式。而對于兩種方式的收獲階段都(dōu)有相(xiàng)關的規定,每次收獲後均應檢測抗體(tǐ)含量,細菌内毒素及支原體(tǐ)。對于限定細胞傳代次數的生(shēng)産方式,需要采用适當的體(tǐ)外方法,對3次收獲物進行外源病毒的檢測。
文章(zhāng)由珈創生(shēng)物前沿技術(shù)研究院提供