珈創生(shēng)物 —— 生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業
優質高效透明
High quality, efficient and transparent
發布時間:2022-11-23 15:49 信息來(lái)源: 閱讀(dú)次數: 次
自(zì)1992年(nián),美國(guó)生(shēng)物學家Arnold Caplan教授命名 “間充質幹細胞”并開啓了世界上第一例間充質幹細胞的臨床探索至今,人(rén)類探索幹細胞臨床應用的曆史已三十餘年(nián)。幹細胞是一類具有不同分(fēn)化潛能,并能在非分(fēn)化狀态下自(zì)我更新的細胞。常用于細胞治療的幹細胞一般可(kě)分(fēn)爲胚胎幹細胞、成體(tǐ)幹細胞(如(rú)脂肪間充質幹細胞、骨髓間充質幹細胞、臍帶間充質幹細胞等)、誘導多能幹細胞。
幹細胞治療是指應用人(rén)自(zì)體(tǐ)或異體(tǐ)來(lái)源的幹細胞,經體(tǐ)外操作(zuò)後輸入(或植入)人(rén)體(tǐ),用于疾病治療。這種體(tǐ)外操作(zuò)包括幹細胞的分(fēn)離(lí)、純化、擴增、修飾、幹細胞(系)的建立、誘導分(fēn)化、凍存和凍存後的複蘇等過程。
研究近況
目前在clinicaltrials.gov網站(zhàn)上已登記的幹細胞臨床研究項目超過1W個,10多款産品在各國(guó)已獲批上市,大(dà)部分(fēn)已獲批上市的産品主要是根據其免疫調控和組織修複兩個生(shēng)物學特性應用于相(xiàng)應适應症,如(rú)移植物抗宿主病、膝骨關節炎、克羅恩病,嚴重肢體(tǐ)缺血等。
幹細胞産品工(gōng)藝簡介
幹細胞制劑的制備工(gōng)藝包括幹細胞的采集、分(fēn)離(lí)、純化、擴增和傳代,幹細胞(系)的建立、向功能性細胞定向分(fēn)化,培養基、輔料和包材的選擇标準及使用,細胞凍存、複蘇、分(fēn)裝和标記,以及殘餘物去(qù)除等。
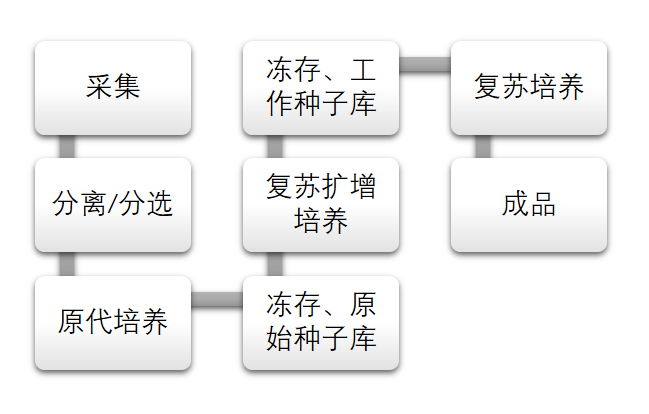
幹細胞産品工(gōng)藝流程▲
點擊看(kàn)大(dà)圖
“類雙軌制”監管模式
在我國(guó),幹細胞治療産品目前處在“類雙軌制”的監管階段。按照(zhào)“藥品監管”,該類監管是指由企業通過注冊IND并完成三期臨床試驗,最後作(zuò)爲藥品上市銷售;按照(zhào)“醫療技術(shù)監管”,該類監管是指根據衛健委和藥監局出台的《幹細胞臨床研究管理(lǐ)辦法》,通過兩委局的備案以後,開展研究者發起的幹細胞臨床研究。無論何種途徑,其向臨床轉化的過程都(dōu)必須遵守相(xiàng)關規定,嚴格執行行業标準。
随着細胞治療産品的蓬勃發展和相(xiàng)應法規及技術(shù)指南(nán)的不斷完善,幹細胞臨床研究和轉化以按“藥品管理(lǐ)”爲主的趨勢正逐漸明朗,研究者從(cóng)早期的研究階段開始,就(jiù)必須考慮到作(zuò)爲藥物研發亦或是臨床研究備案時的方方面面,以提高轉化效率。
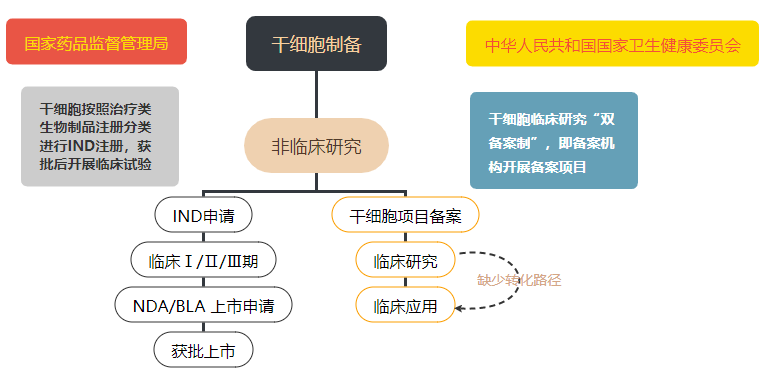
幹細胞監管模式▲
點擊看(kàn)大(dà)圖
相(xiàng)關法規指導要點
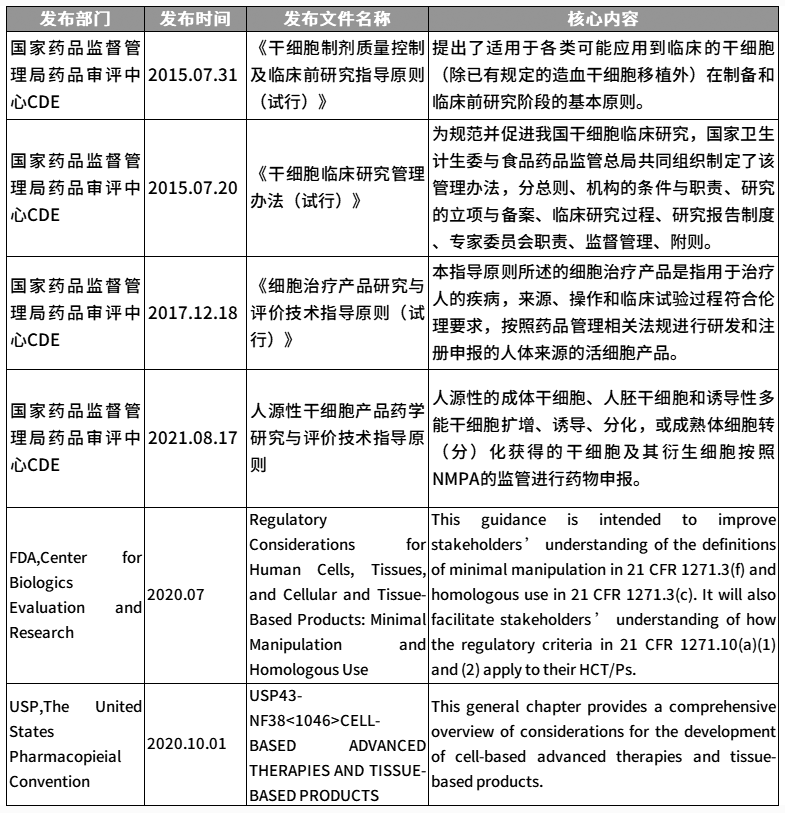
幹細胞法規文件(jiàn)▲
點擊看(kàn)大(dà)圖
回複“幹細胞質量控制”,獲取相(xiàng)關法規文件(jiàn)原件(jiàn)
根據相(xiàng)應法規和指導文件(jiàn),對生(shēng)産過程中的使用材料、生(shēng)産工(gōng)藝和過程控制、質量研究和控制、穩定性研究等的基本要求彙總如(rú)下:
01
相(xiàng)關依據
幹細胞臨床研究應當符合《藥物臨床試驗質量管理(lǐ)規範》的要求;幹細胞制劑符合《幹細胞制劑質量控制及臨床前研究指導原則(試行)》的要求;幹細胞制劑的制備應當符合《藥品生(shēng)産質量管理(lǐ)規範》(GMP)的基本原則和相(xiàng)關要求。
02
全過程質量控制
所有幹細胞制劑都(dōu)可(kě)遵循一個共同的研發過程,即從(cóng)幹細胞制劑的制備、體(tǐ)外試驗、體(tǐ)内動物試驗,到植入人(rén)體(tǐ)的臨床研究及臨床治療的過程。整個過程的每一階段,都(dōu)須對所使用的幹細胞制劑在細胞質量、安全性和生(shēng)物學效應方面進行相(xiàng)關的研究和質量控制。幹細胞生(shēng)産過程中的每一個生(shēng)産步驟均應該進行研究與驗證,并根據工(gōng)藝特點設置重要工(gōng)藝步驟的監控點,加強監控。
03
原材料控制
幹細胞産品生(shēng)産用的生(shēng)物材料,如(rú)細胞株、培養基、滋養層細胞、動物來(lái)源的試劑和血清等,企業應當保證其來(lái)源合法、安全并符合質量标準,防止引入或傳播傳染病病原體(tǐ)。
04
産品檢測
幹細胞産品的檢測機(jī)制建議(yì)采用質量檢驗和放(fàng)行檢驗與專業檢測機(jī)構複核檢測相(xiàng)結合的方法,即這種“質量檢驗” -“放(fàng)行檢驗” -“複核檢驗”的評價體(tǐ)系。
質量檢驗
爲保證幹細胞經特定體(tǐ)外處理(lǐ)後的安全性、有效性和質量可(kě)控性而進行的較全面質量檢驗。須對多批次幹細胞制劑進行質量檢驗,檢定項目應當建立在産品質量研究以及對生(shēng)産工(gōng)藝和生(shēng)産過程充分(fēn)理(lǐ)解的基礎之上,同時兼顧産品的特性和當下的科(kē)學認知與共識。
放(fàng)行檢驗
在完成質量檢驗的基礎上,對每一類型的每一批次幹細胞制劑,在臨床應用前所應進行的相(xiàng)對快(kuài)速和簡化的細胞檢驗。可(kě)建立針對不同階段關鍵制備工(gōng)藝的過程控制,和針對不同組織來(lái)源批次及生(shēng)産制備批次的中間細胞形态和終末制劑标準放(fàng)行的評價規範。
質量複核
由專業細胞檢驗機(jī)構/實驗室進行幹細胞制劑的質量複核檢驗,并出具檢驗報告。
05
質量研究
幹細胞産品的質量研究應選擇有代表性的生(shēng)産批次和合适的生(shēng)産階段樣品(如(rú)初始分(fēn)離(lí)的細胞、制備過程中細胞或成品等)進行研究。質量研究應涵蓋細胞特性分(fēn)析、功能性分(fēn)析、純度分(fēn)析和安全性分(fēn)析等方面,并且根據産品的自(zì)身(shēn)特性可(kě)再增加其他(tā)相(xiàng)關的研究項目。
風(fēng)險評估與控制
除了一般生(shēng)物制品的常見(jiàn)風(fēng)險外,幹細胞産品的風(fēng)險還(hái)包括污染和交叉污染的風(fēng)險(供者、原材料、操作(zuò)過程)、 高風(fēng)險起始原材料(ESCs/iPSCs、基因遞送與修飾系統)殘留的風(fēng)險、 加工(gōng)過程中非目的細胞、非預期變化等雜質的風(fēng)險、生(shēng)産工(gōng)藝變更的風(fēng)險和幹細胞産品的其他(tā)質量風(fēng)險因素。
研發者應在綜合考慮各種因素的基礎上,針對不同類型産品特性和全生(shēng)命周期過程評估産品的總體(tǐ)風(fēng)險,并制定相(xiàng)應的風(fēng)險控制策略。
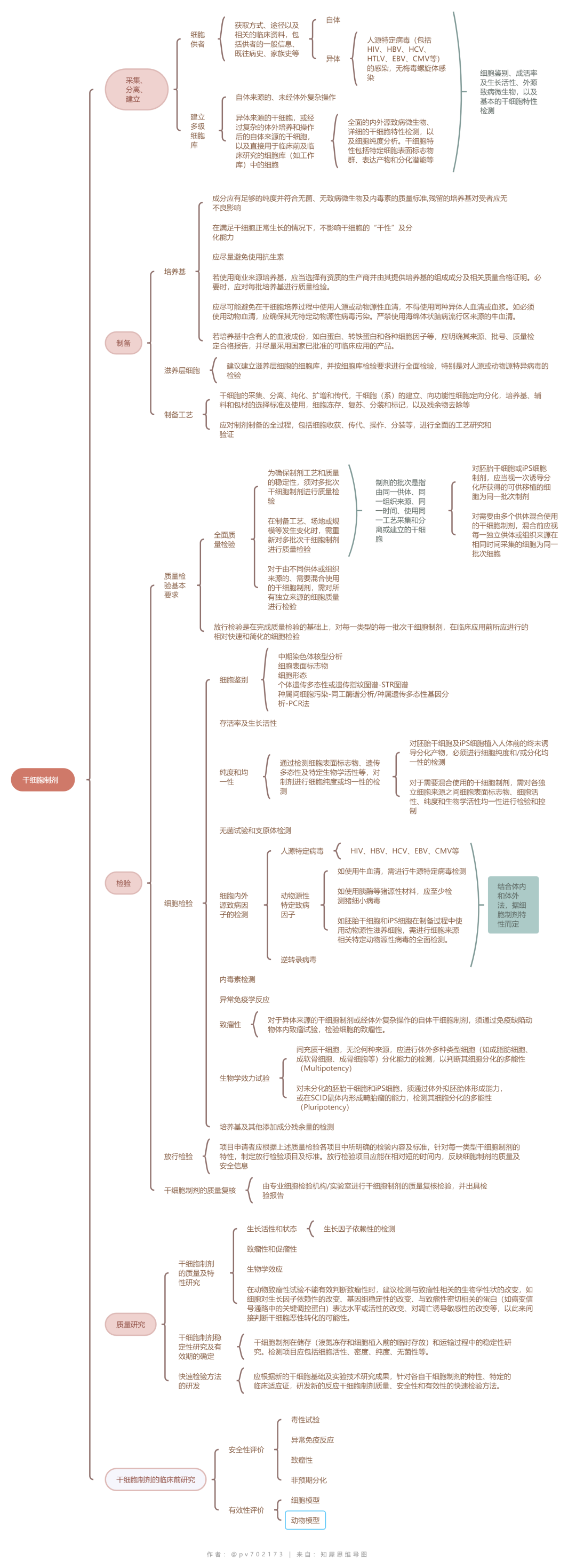
幹細胞質量控制▲
點擊看(kàn)大(dà)圖
武漢珈創生(shēng)物相(xiàng)關服務
金華海孚生物技術有限公司,創建于2011年(nián),是一家集生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業,專注于爲生(shēng)物藥品/制品的生(shēng)産企業及研發機(jī)構提供各類細胞(含重組細胞、幹細胞、免疫細胞等)及原輔料的質量檢測、病毒清除工(gōng)藝驗證技術(shù)服務。
質量檢測服務
武漢珈創生(shēng)物可(kě)按相(xiàng)關法規或者指導文件(jiàn)提供幹細胞治療産品的各個生(shēng)産環節的質量檢測服務,包括:
基本生(shēng)物學屬性檢測
細胞鑒别、細胞活性檢測、種屬間細胞污染的檢測、染色體(tǐ)核型分(fēn)析;
微生(shēng)物學安全性檢測
無菌檢測、支原體(tǐ)檢測,确保産品無微生(shēng)物污染或代謝産物污染;
生(shēng)物學安全性檢測
成瘤性和緻瘤性檢測、異常免疫反應檢測、殘留物的檢測;
生(shēng)物學有效性評價
多向分(fēn)化功能的評價、免疫調控功能的評價、hMSCs組織再生(shēng)功能的評價
幹細胞放(fàng)行快(kuài)檢
珈創生(shēng)物自(zì)主研發的放(fàng)行快(kuài)檢技術(shù),可(kě)在6小時内完成,涵蓋細菌、真菌和支原體(tǐ)快(kuài)檢技術(shù),且技術(shù)方法已成熟,經過了上百次驗證。
定制化服務
針對特殊需求,我們還(hái)可(kě)提供定制化的檢測服務,歡迎新老客戶前來(lái)咨詢。
參考資料:
[1]周萍,李昂,李欣,陸東哲,王曉熙,吳朝晖,薛迪.幹細胞研究與臨床應用的倫理(lǐ)規範與監管[J/OL].上海預防醫學:1-5[2022-11-02].http://kns.cnki.net/kcms/detail/31.1635.R.20220721.1739.013.html
[2]王晶,黃(huáng)雲虹,高晨燕.我國(guó)間充質幹細胞産品的注冊申請(qǐng)情況及臨床審評中的幾點考慮[J].中國(guó)新藥雜志,2022,31(15):1468-1473.
[3]一文覽盡:中國(guó)幹細胞藥物注冊申報和受理(lǐ)
https://mp.weixin.qq.com/s/PhoTzjxpVmGwahQe2K4nqw
[4]張可(kě)華,納濤,韓曉燕,吳婷婷,張麗霞,賈春翠,袁翔鶴,馮建萍,項楠,孟淑芳.幹細胞臨床研究質量複核中發現的問(wèn)題及初步分(fēn)析[J].中國(guó)新藥雜志,2021,30(19):1746-1751.

END