珈創生(shēng)物 —— 生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業
優質高效透明
High quality, efficient and transparent
發布時間:2022-12-05 16:32 信息來(lái)源: 閱讀(dú)次數: 次
來(lái)源于人(rén)或動物細胞系的生(shēng)物技術(shù)産品的一個共同特點是存在病毒污染的風(fēng)險,污染可(kě)來(lái)自(zì)原細胞系(細胞基質)本身(shēn),也可(kě)來(lái)自(zì)生(shēng)産過程中偶然帶入的外源病毒,這種污染可(kě)能産生(shēng)嚴重的臨床後果。
風(fēng)險控制原則
控制生(shēng)物技術(shù)産品的潛在病毒污染,可(kě)歸納爲以下三條相(xiàng)互補充的原則:
a)選擇并對選定的細胞系和其他(tā)原料進行檢定,确保其不含可(kě)能對人(rén)有感染和/或緻病作(zuò)用的病毒。
b)評估生(shēng)産工(gōng)藝清除感染性病毒的能力。
c)檢測生(shēng)産适當步驟的産品,确保産品未受感染性病毒的污染。
各級細胞病毒安全性控制
細胞庫包括原始細胞庫(PCB,又稱細胞種子)、主細胞庫(MCB)和工(gōng)作(zuò)細胞庫(WCB)。
ICH Q5A(R1)及USP-NF<1050>中對不同級别細胞進行病毒檢測的建議(yì):
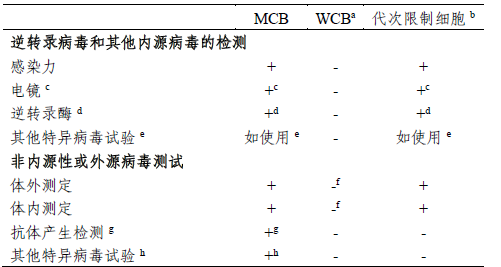
a.作(zuò)爲藥物生(shēng)産起始細胞基質的工(gōng)作(zuò)細胞庫,必須進行外源病毒檢測,既可(kě)對WCB進行直接測定,也可(kě)對從(cóng)WCB來(lái)源的體(tǐ)外傳代限度内的細胞進行分(fēn)析。
b. 達到限傳代次的細胞:在體(tǐ)外達到傳代限度的生(shēng)産細胞。
c. 也可(kě)測定其他(tā)因子。
d. 若逆轉錄病毒感染試驗爲陽性,則無須檢測。
e. 指使用于已受此因子感染的細胞系。
f. 對第一個WCB,此測試應在該WCB産生(shēng)的達到體(tǐ)外限傳代次細胞上進行;以後的WCB,可(kě)直接在WCB上進行單項體(tǐ)外和體(tǐ)内測試,或在達到體(tǐ)外限傳代次的細胞上測試。
g. 例如(rú),MAP、RAP、HAP-通常适用于齧齒細胞系。
h. 例如(rú),适用于人(rén)、非人(rén)靈長目或其他(tā)細胞的測試方法。
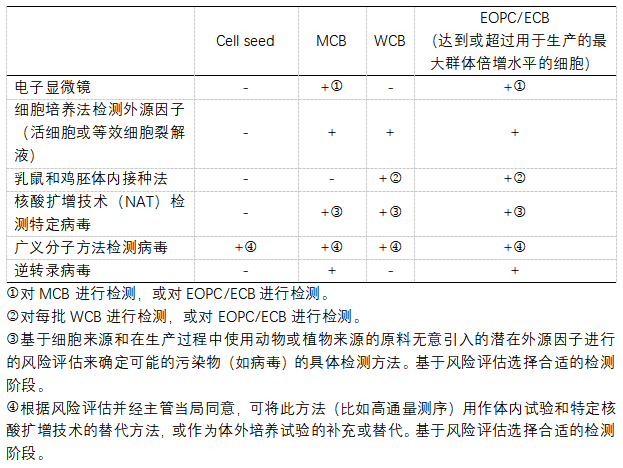
EP10.0 <5.2.3>中對不同級别細胞系進行病毒檢測的建議(yì):
中國(guó)藥典三部(2020版)對細胞基質及細胞庫體(tǐ)系的病毒檢查的建議(yì):
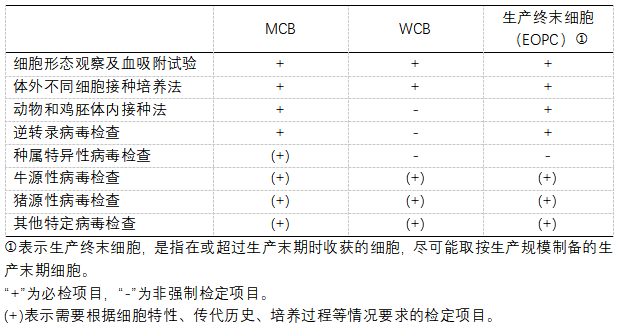
通過以上法規要求可(kě)以看(kàn)出,對于細胞基質和各級細胞庫,具體(tǐ)的檢定項目需要根據特定的細胞特性、傳代曆史、培養過程、生(shēng)産工(gōng)藝等進行綜合評估。根據ICH Q5A的要求,應對MCB進行内源性和非内源性病毒污染的檢測;如(rú)果不檢測MCB,也可(kě)以使用WCB全面檢測進行替代。
生(shēng)産過程中感染性病毒污染的風(fēng)險控制
雖然在細胞庫階段對MCB 和WCB 進行了内外源病毒因子檢測,但(dàn)有些内源性病毒可(kě)能在MCB 和WCB 階段未被檢出,或者在生(shēng)産過程中引入偶然的病毒因子污染,因而對生(shēng)産終末細胞和/或細胞收獲液中的病毒因子進行檢測和控制非常重要。
對于UPB樣品,ICH Q5A僅要求在進行上市注冊申請(qǐng)時,至少應上報三批試生(shēng)産或規模化生(shēng)産的UPB研究資料,一般使用一種或幾種細胞系進行體(tǐ)外篩查試驗。如(rú)适用,可(kě)使用PCR試驗或其他(tā)适當的方法。EMA文件(jiàn)《Guideline on Virus Safety Evaluation of Biotechnological Investigational Products》則指出,每一批用于臨床試驗的UPB均應按照(zhào)ICH Q5A的要求進行檢測,具體(tǐ)不同細胞系對應的檢測方法也有不同。
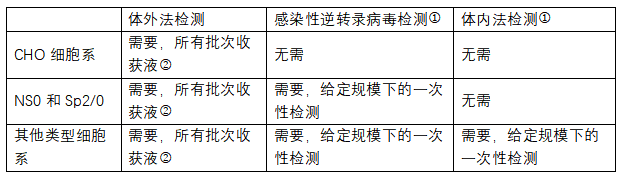
①如(rú)果可(kě)能,檢測樣品應包括細胞或細胞碎片以進行細胞相(xiàng)關病毒檢測。對于灌注式細胞培養,生(shēng)産商應确定并證明最适合的樣品(含細胞的樣品)收集步驟,收集超出批量生(shēng)産代次的細胞檢測樣品也是可(kě)行的;在上述情況下,應證明采用分(fēn)析方法的合理(lǐ)性;如(rú)果已有敏感度更高的方法可(kě)表明感染逆轉錄病毒檢測結果爲陰性,則感染性逆轉錄病毒的檢測可(kě)忽略。②僅需在研發的特定階段對前三批原液進行逆轉錄病毒或逆轉錄病毒顆粒的檢測(如(rú)果制備批次不足三批,也可(kě)用更少批次)。
FDA指導文件(jiàn)《Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use》中則對UPB、純化中間品和成品的病毒檢測都(dōu)有不同要求。對于每個批次收獲液需要進行外源病毒因子、種屬特異性病毒、逆轉錄病毒或逆轉錄病毒顆粒定量的檢測。
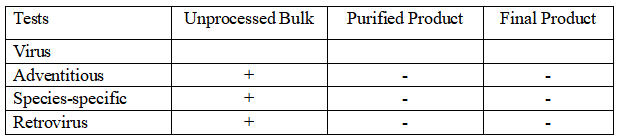
根據中國(guó)藥典三部(2020版)要求對于人(rén)用生(shēng)物制品生(shēng)産用動物細胞基質及檢定用動物細胞,需要對MCB進行全面檢定,并且需要對EOPC進行檢定。對于人(rén)用重組單克隆抗體(tǐ)制品生(shēng)産,應根據生(shēng)産過程及所用材料的特點,在合适的階段進行常規或特定的外源病毒污染檢查。除另有規定外,應對限定細胞傳代次數的生(shēng)産方式,采用适當的體(tǐ)外方法至少對3次收獲物進行外源病毒檢測。
相(xiàng)關法規指導
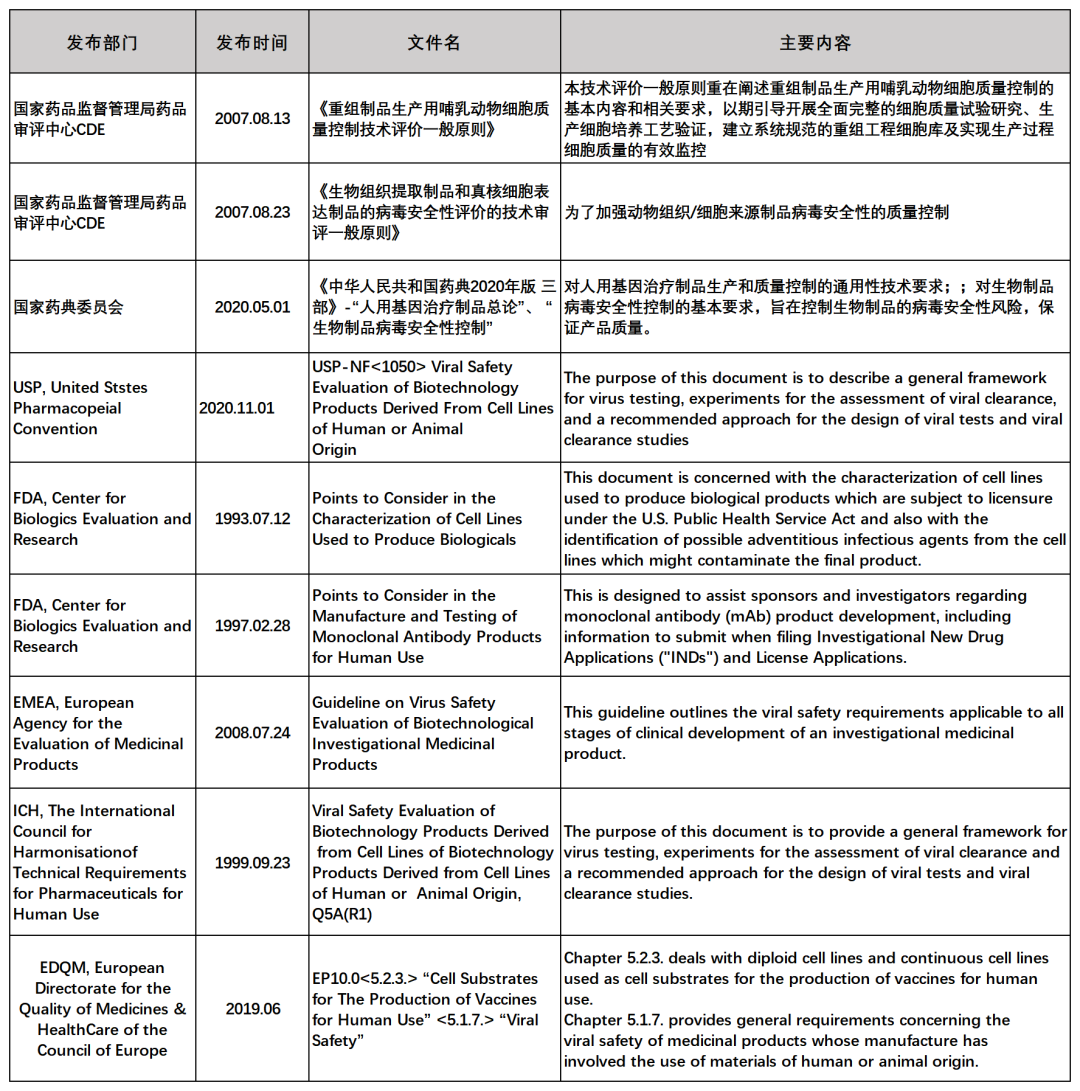
近年(nián)來(lái),雖然對于内外源病毒因子檢測中外申報要求各異,但(dàn)2020年(nián)1月NMPA發布的“國(guó)家藥監局關于适用《Q2(R1):分(fēn)析方法論證:正文和方法學》等11個國(guó)際人(rén)用藥品注冊技術(shù)協調會指導原則的公告(2020年(nián)第7号)”中包含ICH Q5A(R1)和Q5B等文件(jiàn),這表明國(guó)内法規正逐漸與國(guó)際相(xiàng)關法規接軌,給國(guó)内制藥企業進行中外雙報帶來(lái)了便利,從(cóng)而加速藥品上市。
後台回複“病毒檢測指導”,獲取相(xiàng)關指導文件(jiàn)。
武漢珈創生(shēng)物相(xiàng)關服務
金華海孚生物技術有限公司,創建于2011年(nián),是一家集生(shēng)物技術(shù)服務與研發爲一體(tǐ)的高新技術(shù)企業,專注于爲生(shēng)物藥品/制品的生(shēng)産企業及研發機(jī)構提供各類細胞(含重組細胞、幹細胞、免疫細胞等)及原輔料的質量檢測、病毒清除工(gōng)藝驗證技術(shù)服務。
質量檢測服務
武漢珈創生(shēng)物可(kě)按相(xiàng)關法規或指導原則提供各類細胞基質的成瘤性檢查服務,且有多種檢測方法可(kě)供選擇如(rú)動物體(tǐ)内接種法(裸鼠)、軟瓊脂克隆形成試驗、端粒酶活性檢測等,至今已完成數萬批次的細胞及産品檢測服務。
定制化服務
針對特殊需求,我們還(hái)可(kě)提供定制化的檢測服務,歡迎新老客戶前來(lái)咨詢。

END